Assalamualaikum wr.wb.
Good Morning Everybody.
How are you today?
I hope all of you healty and fresh.
I hope all of you keep spirit in pandemic situasion.
Before we start our lesson today, let's pray together.
Thanks you
well, to day we are to learn about "Partikel Penyusun Benda dan Makhluk Hidup"
let's go
BAB VIII
PARTIKEL PENYUSUN BENDA DAN MAKHLUK HIDUP
1. Molekul dalam Benda Mati dan Makhluk Hidup
Di alam ini terjadi proses pembentukan zat seperti fotosintesis dan proses penguraian zat seperti pembusukan daun. Zat di alam tersusun atas materi sangat kecil yang disebut atom. Fotosintesis terjadi dalam organel yaitu kloroplas. Kloroplas terdiri dari molekul klorofil yang memiliki struktur sebagai berikut :
Klorofil merupakan senyawa yang tersusun atas beberapa atom diantaranya karbon (C), hidrogen (H), oksigen (O), Nitrogen (N) dan Magnesium (Mg). Glukosa mempunyai atom – atom penyusun yaitu hidrogen, oksigen dan karbon. Atom – atom penyusun glukosa sama seperti pada karbon dioksida (CO2) dan air (H2O).
Jika satu molekul tersusun atas dua atau lebih atom dari unsur yang berbeda, maka disebut molekul senyawa.
Berikut model ikatan kimia pada CO2
Pembentukan glukosa pada fotosintesis, penguraian sampah, siklus gas karbondioksida dan siklus nitrogen merupakan contoh proses kimia yang terjadi di alam dan dapat menjaga keseimbangan alam. Zat – zat kimia yang diperlukan makhluk hidup ada yang disediakan oleh alam, ada juga yang dibuat oleh manusia melalui proses kimia dalam industri. Pupuk buatan seperti Urea mengandung nitrogen dalam bentuk ion amonium(NH4 +). Pupuk NPK mengandung nitrogen, fosfor dan kalium yang digunakan petani untuk menyuburkan tanaman
2. Atom dan Partikel Penyusunnya
Atom adalah unit terkecil dari suatu materi. Atom terdiri atas sub atom yaitu elektron, neutron dan proton. Neutron dan proton membentuk inti atom (nukleus).
Elektron bermuatan negatif, proton bermuatan positif dan neutron tidak bermuatan. Berikut struktur atom helium (He) :
Pada atom netral, jumlah proton dan elektron adalah sama. Setiap partikel penyusun subatom mempunyai massa. Elektron mempunyai massa sangat kecil dibanding proton dan neutron, sehingga massa atom berpusat pada inti atom saja.
Berikut perkembangan teori atom
| Penemu/ Teori Atom | Model Atom | Penjelasan |
| John Dalton | Atom sebagai bola pejal dan merupakan bagian terkecil yang tidak dapat dibagi lagi. Setiap unsur terdiri atas atom-atom yang identik. Atom-atom dari unsur berbeda mempunyai atom berbeda. Atom-atom dapat bergabung dengan perbandingan tertentu membentuk senyawa. | |
| Joseph John Thompson | Atom merupakan bola bermuatan positif dan di tempat-tempat tertentu terdapat elektron-elektron yang bermuatan negatif seperti kismis dalam roti. | |
| Ernest Rutherford | Atom sebagai bola yang di tengah – tengahnya terdapat inti atom yang merupakan pusat muatan positif dan pusat massa. Sedangkan elektron-elektron berputar mengelilingi inti. | |
| Niels Bohr | Atom terdiri terdiri atas inti yang menjadi pusat massa atom dan pusat muatan positif. Sedangkan elektron bergerak disekeliling inti pada lintasan tertentu (orbit) yang disebut kulit-kulit atom. Selama elektron mengelilingi inti, elektron tidak memancarkan energi. | |
| Modern (Mekanika gelombang) | Atom tersusun atas partikel sub atom yaitu neutron (n), proton (p), dan elektron (e). Neutron dan proton menjadi satu membentuk inti yang padat disebut nukleus atau inti atom. Elektron bergerak disekeliling inti hampir dalam kecepatan cahaya membentuk awan elektron. |
Menurut Bohr, atom memiliki kulit atom tempat elektron mengellilingi nukleus. Kulit atom yang dekat dengan nukleus (paling dalam) memiliki energi yang rendah, sedang yang jauh dari nukleus (paling luar) memiliki energi tinggi.
Nomor Atom dan Nomor Massa
Setiap atom memiliki nomor atom dan nomor massa yang berbeda. Hal ini karena jumlah elektron, proton dan neutronnya berbeda. Jika massa atom nya berbeda, maka jari – jari atom pun berbeda.
Pada penulisan lambang unsur, nomor atom ditulis subscrip (turun) di kiri lambang unsur. Nomor massa ditulis superscrip (naik) di kiri lambang unsur seperti berikut :
Contohnya, unsur litium memiliki nomor atom 3 dan nomor massa 7, sehingga penulisan lambang unsurnya yaitu :
Unsur – unsur logam mulia seperti emas (Au), perak (Ag) dan Platina (Pt) mempunyai nilai ekonomi tinggi, karena dapat dijadikan sebagai perhiasan. Unsur yang ada di alam sangat penting untuk kehidupan. Namun beberapa unsur seperti merkuri (Hg), timbal (Pb) dan logam berat lain berbahaya bagi organisme terutama manusia.
Contoh beberapa unsur
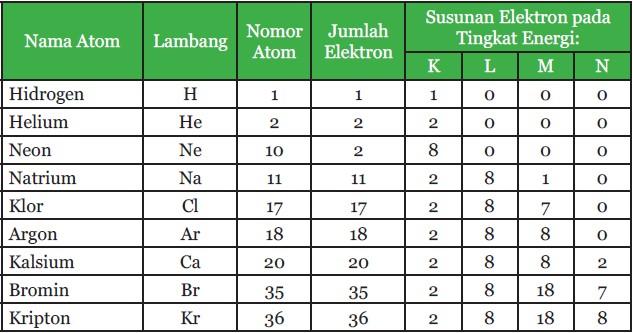
Konfigurasi elektron adalah susunan elektron pada sebuah atom, molekul atau struktur fisik lainnya. Menurut teori mekanika gelombang, tingkat – tingkat energi atau kulit – kulit atom berturut – turut adalah tingkat energi K atau n = 1, L untuk n = 2, M untuk n = 3 dan seterusnya. Setiap kulit atom ditempati oleh beberapa atom dan mempunyai jumlah elektron maksimal.
Berikut nama kulit atom dan jumlah elektron maksimalnya
Berikut susunan kulit atom dan tingkat energinya
 a
a
Cara untuk menentukan jumlah elektron maksimal pada setiap kulit atom yaitu menggunakan rumus :
= elektron maksimal ; n = kulit ke-
Contohnya platinum (Pt) memiliki nomor atom 78. Bagaimanakah konfigurasi elektronnya? Konfigurasi elektron dari platinum : 2, 8, 18, . . .
Pada kulit ke 4, jumlah elektron maksimalnya yaitu :
= 2 ×
= 2 × 16
= 32
Sehingga, konfigurasi elektron pada platinum = 2, 8, 18, 32, 18
Atom – atom dengan nomor atom 1 sampai 18 akan stabil apabila kulit terluarnya berisi 2 elektron seperti helium (He) atau 8 elektron seperti Neon (Ne), Argon (Ar) dan Kripton (Kr). Untuk mencapai jumlah elektron 8, maka atom akan melepas atau menerima elektron.
Contohnya, atom Natrium mempunyai nomor atom 11, sehingga konfigurasi elektron nya: 2, 8, 1. Karena elektron terluarnya 1, maka natrium melepaskan 1 elektron agar stabil. Sehingga, natrium menjadi ion natrium yang memiliki satu muatan positif karena melepaskan 1 elektron dan bisa ditulis dengan
4. Ion
Ion adalah suatu atom atau molekul yang memiliki muatan positif atau negatif. Apabila bermuatan positif disebut kation, apabila bermuatan negatif disebut anion.
Kation disebut juga ion bermuatan positif. Kation terbentuk jika atom logam atau kelompok atom melepas elektron. Anion disebut juga ion bermuatan negatif. Anion terbentuk jika atom nonlogam menangkap elektron.
Contohnya, klor mempunyai nomor atom 17, sehingga konfigurasi elektronnya : 2, 8, 7. Karena elektron terluarnya 7, maka klor menangkap 1 elektron agar stabil. Sehingga, klor menjadi ion klor bermuatan negatif atau bisa ditulis
Senyawa ionik adalah senyawa yang terbentuk dari kation dan anion. Dalam senyawa ionik, terjadi gaya tarik menarik (gaya elektrostatik) antara kation dan anion yang disebut dengan ikatan ion. Contohnya proses pembentukan garam dapur, seperti gambar berikut :
Unsur – unsur logam cenderung melepaskan elektron sehingga bermuatan positif (membentuk kation), unsur – unsur non logam cenderung menerima elektron sehingga bermuatan negatif (membentuk anion).
Kecenderungan atom menerima atau melepas elektron bisa diketahui dari jumlah elektron terluarnya. Apabila jumlah elektron terluar lebih dari 5 maka cenderung menerima elektron, jika kurang dari 4 cenderung melepas elektron.
Minuman penyegar atau isotonik mengandung beberapa jenis ion seperti kalium (
Sehingga, apabila tubuh kehilangan ion maka bisa minum minuman isotonik untuk mengganti ion tubuh yang hilang. Atom – atom dapat menggunakan elektron secara bersamaan. Contohnya atom hidrogen (H) yang mempunyai 1 atom. Sehingga akan stabil apabila menerima elektron atau saling berikatan sesama atom H dengan membentuk
Ikatan kimia melalui penggunaan bersama elektron antar 2 atom disebut dengan ikatan kovalen. Ikatan antara atom H dengan atom H atau Cl dengan Cl biasanya ditulis dengan lambang H – H atau Cl – Cl. Satu tanda garis mewakili satu elektron yang digunakan bersama.
Sedangkan atom N memerlukan 3 elektron agar lebih stabil, sehingga menggunakan elektron secara bersamaan dengan sesama atom N. Ikatan kovalen pada atom O dapat ditulis dengan O = O, ikatan kovalen pada atom N ditulis dengan N ≡ N. Senyawa yang antar atomnya berikatan kovalen disebut dengan senyawa kovalen.
Jika belum jelas silahkan baca buku paket bab 8 halaman 96- 125. Untuk lebih memahami materi, kerjakan latihan berikut:




Tidak ada komentar:
Posting Komentar